
Entrar
Digite seus dados para acessar sua conta

Criar conta
Ainda não possue cadastro?
Preencha os campos e faça parte

Entrar
Digite seus dados para acessar sua conta

Criar conta
Ainda não possue cadastro?
Preencha os campos e faça parte
Alguns questionamentos sobre a Tireoide ou Tiroide (a língua portuguesa considera as duas formas corretas) são sempre feitos, como se engorda ou emagrece, se tem tratamento, se está alta ou baixa, quais seus sintomas etc. Neste artigo você irá conhecer mais a respeito dessa glândula e como ela interfere em seu organismo.
Constata-se que a glândula tireoide se localiza abaixo da laringe, em ambos os lados da traqueia e na sua parte anterior são produzidos dois hormônios de extrema importância para o metabolismo do organismo, a tiroxina (T4) e a triiodotironina (T3). A tireoide ainda é responsável pela produção de calcitonina, um hormônio relacionado ao metabolismo do cálcio.
De acordo com Greenspan e Strewler (2000, p. 01):
A tireoide é uma importante glândula do nosso organismo e produz hormônios que tem como uma das suas principais funções regular o metabolismo. Quando ela não funciona adequadamente pode levar a repercussões em todo o corpo em graus variáveis de severidade, desde sintomas que muitas vezes podem passar despercebidos até formas extremamente graves que podem trazer risco de vida.
Hormônios Tireoideanos
Os hormônios da tireóide (T3 – triiodotironinae T4 – tiroxina) agem em quase todas as células do corpo humano, além de controlar várias atividades, como, por exemplo, os batimentos cardíacos, o peristaltismo e até mesmo a respiração celular. A ação desses hormônios também acelera o metabolismo, controlando o crescimento e o desenvolvimento do organismo.
Dessa forma, os hormônios tireoideanos (HT) são sintetizados pela glândula tireoide que está localizada no pescoço, na face anterior da traqueia, entre a cartilagem cricóide e o estreito supraesternal (ROSS, 2008 apud OLIVEIRA, 2009). Microscopicamente a tireoide apresenta folículos em forma de esferas ou ácinos, cada um composto por uma única camada de células em torno do lúmen preenchido com colóide, constituído principalmente por tireoglobulina (glicoproteína de 660kDa) (ROSS, 2008 apud OLIVEIRA, 2009).
Conforme Guyton (1989, p. 712):
A primeira etapa da síntese dos hormônios tireiódeos consiste no transporte dos iodetos do líquido extracelular para as células glandulares e os folículos da tireoide. A membrana basal da célula tireoide tem a capacidade específica de transportar ativamente o iodeto para o interior da célula. Este processo é denominado capacitação do iodeto. Na glândula normal, a bomba do iodeto concentra cerca de 30 vezes a concentração sanguínea de iodeto. Todavia, quando a atividade da glândula tireoide se torna máxima, a relação entre essas concentrações pode aumentar até várias vezes acima desse valor.
Diante disso, convém ressaltar que os hormônios tireoideanos, ligados às tiroglobulinas, permanecem armazenados no colóide e, quando requisitados, são liberados como iodotironinas hormonalmente ativas. A glândula tiroide contém grandes quantidades de HT armazenados que, desta forma, independente da necessidade de síntese imediata, podem ser secretados mais rapidamente quando exigido, o que geralmente ocorre após bruscas alterações hormonais (ROSS, 2008 apud OLIVEIRA, 2009).
Visser (1999) apud Oliveira (2009, p. 11) explica que:
A glândula tireoide produz predominantemente o pró-hormônio T4, juntamente com uma pequena quantidade de T3 – o hormônio bioativo. A maioria do T3 é produzida por desiodação enzimática do anel externo (ORD) de T4, em tecidos periféricos. Alternativamente, desiodação do anel interno (IRD) de T4 produz o metabólito 3,3’, 5’- triiodotironina (T3 reverso [rT3]), que não tem atividade biológica determinada. O restante do T4 é metabolizado por diferentes vias identificadas por conjugação do grupo hidroxilfenólico ao sulfato ou ao ácido glicurônico. Estas reações permitem aumento da solubilidade dos substratos e, deste modo, facilitam a depuração biliar ou excreção urinária.
Em conformidade com o citado acima Oliveira (2009, p.11) afirma que:
O T3 é metabolizado, em sua maior parte, por IRD e o rT3 por ORD produzindo, nos dois casos, o metabólito 3,3’- diiodotironina (T2). Assim, ORD é considerada um via de ativação e IRD de inativação. A bioviabilidade de HT é determinada, desta forma, por vários fatores, incluindo a secreção tireoideana de T4 e T3, a conversão de T4 em T3 por ORD e a inativação de T4 e T3 por IRD.
Sendo assim, após o término da sua formatação o HT é, finalmente, liberado da glândula tireoideana por endocitose permitindo sua passagem do colóide para o lúmen folicular, processo que é estimulado pelo hormônio estimulante da tireoide (TSH). As vesículas formadas fusionam-se aos lisossomos e a proteólise é catalisada pela catepsina. O T4 e o T3 são, então, liberados no interior das células da tireoide e por ação do TSH em receptores celulares atingem a circulação como pró-hormônio ou com T3 (WILSON, 1998 apud OLIVEIRA, 2009).
Diante disso, Engler (1984) apud Oliveira (2009, p. 12) relata o seguinte sobre a produção de T4 e T3:
A taxa de produção de T4 exclusivamente produzida pela tireoide é de 80 a 100mg (100 a 130 nmoles) por dia. Aproximadamente 10% de T4 é degradada por dia e cerca de 80% é desiodada, metade para formação de T3 e a outra metade para formar rT3. O restante pode ser conjugado, desanimado e decarboxilado formando o ácido tetraiodotiroacético (Tetrac) ou ainda, clivado entre os dois anéis. A conversão de T4 em T3 em outros tecidos, que não a glândula tireoide, leva a um aumento em sua atividade biológica e é regulada, de modo que a produção de T3 possa mudar independente de alterações na função hipófise-tireoide. A produção de T3 é de 30 a 40 mg (45 a 60 nmoles) por dia, embora a produção extratireoidal seja de cerca de 50 mg (75 nmoles), a maioria dos quais é intracelular. O T3 em torno de 75%, já o rT3 é produzido de 30 a 40 mg (45 s 60 nmoles) por dia, quase totalmente por desiodação extratiroidal de T4 e é degradado ainda mais rapidamente do que o T3, principalmente por desiodação.
Desta forma, as transformações metabólicas do HT nos tecidos periféricos determinam seu potencial biológico e regulação de seus efeitos celulares. Uma grande variedade de iodotironinas e dos derivados metabólicos circulam no plasma. As concentrações de T4 e T3 são constantes nos tecidos e podem variar de acordo com a concentração destes livres no plasma. Entretanto, a concentração de T3 livre em diferentes tecidos varia de acordo com a quantidade de hormônio transportado e a atividade das desiodases no tecido.
Ainda sobre os hormônios tireoideanos Murata (2005) apud Oliveira (2009, p. 13) expõe que:
A proteína tetramérica TTR de 55 kDa é sintetizada também pelo fígado. Cada molécula de TTR conta com dois sítios de ligação ao T4, no entanto, a ocupação de um destes sítios diminui a afinidade do segundo ao hormônio. A concentração sérica de TTR é de quase 25 mg/dL (4,6 mmol/L), uma quantidade que pode unir-se a 200 mg de T4 (260 nmoles)10. A TTR, secretada pelo plexo coróide, foi identificada como uma proteína importante para a manutenção de T4 no fluido cerebroespinhal, prevenindo a perda do hormônio para o sangue11. Em experimentos desenvolvidos em girinos, observou-se que as atividades de ligação do HT em proteínas plasmáticas sofrem alterações durante metamorfose, sugerindo um papel regulatório das mesmas.
A albumina por sua vez possui vários sítios de ligação ao T4, sendo um sítio de ligação forte e outros mais fracos. Existem quatro isoformas de albuminas transformadoras com diferentes afinidades para T4 e T3. Como apenas cerca de 12% do T4 está ligado á albumina, alterações em suas concentrações séricas tem pouco efeito sobre as concentrações de T4. Finalmente, T3 e T4 podem ser encontrados ligados e lipoproteínas, principalmente à apolipoproteína Al, um componente de lipoproteínas de alta densidade (BENVENGA, 1998 apud OLIVEIRA, 2009).
O HT está envolvido na regulação da transcrição de genes alvos. O T3 regula a expressão nuclear de genes por sua ligação a TRα e TRβ. Os TR reconhecem elementos tireoideanos específicos nos promotores dos genes-alvo e ativam ou reprimem a transcrição em resposta ao hormônio. Assim, as ações nucleares do T3 são sensíveis aos inibidores da transcrição e tradução e tem a latência de horas ou dias(YEN, 2001 apud OLIVEIRA, 2009). Os receptores nucleares apresentam características determinantes que estão relacionadas à afinidade pelo T3 e T4, aos tipos e localização dos receptores e a variabilidade de ação tecidual. O T3 liga-se mais avidamente que o T4 aos receptores nucleares e in vivo praticamente toda atividade nuclear está vinculada ao T3. Há, ainda, uma variação nas respostas a partir da ocupação dos receptores nucleares. Na hipófise e coração não existe uma correlação linear entre a crescente dos TR e sua conseqüente resposta, enquanto que em outros tecidos a ocupação de TR resulta em amplificação das respostas, como no fígado, na síntese de determinadas enzimas (WILSON, 1998 apud OLIVEIRA, 2009).
Ainda citando Wilson (1998) apud Oliveira (2009, p. 14):
O TSH, por sua vez, é estimulado pelo hormônio liberador de tirotrofina (TRH), que é um tripeptídeo distribuído por toda área do hipotálamo, mas em maior quantidade nos núcleos paraventricular e eminência mediana. O TRH é metabolizado muito rapidamente, sua meia-vida plasmática é de aproximadamente três minutos. O estímulo de TRH sobre a secreção de TSH ocorre pela ativação mediada por receptores via fosfolipase C, o que estimula a mobilização de cálcio intracelular. A estimulação crônica de TRH também aumenta a síntese e glicosilação do TSH, aumentando desta forma a atividade biológica do TSH. A secreção de TRH é pulsátil, assim como a secreção do TSH.
Vale salientar que fora da tireoide, em diversos outros órgãos, a regulação de T3 e T4 está vinculada a alterações nutricionais, hormonais e a fatores relacionados a algumas enfermidades, o que pode variar em diferentes tecidos.
A figura abaixo demonstra a síntese e secreção de hormônios tireoideanos por feed back positivo e negativo.
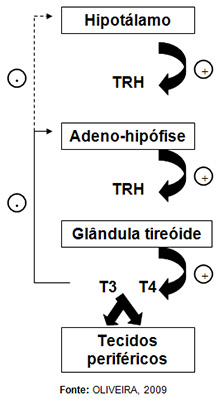
Figura: Controle da síntese e secreção de hormônios tireoideanos por feed back positivo e negativo.
Na tireoide, o mecanismo é extremamente sensível a alterações na secreção de HT e nos tecidos periféricos. Mudanças no status do hormônio preveem rápida resposta disponibilizando HT presente na circulação. Assim, fisiologicamente, o TSH produzido pelas células tirotróficas da hipófise anterior liga-se a receptores específicos nas células da tireoide e estimulam todas as etapas da síntese do T4 e T3, bem como sua liberação pela glândula (YEN, 2001 apud OLIVEIRA, 2009).
Portanto, a síntese e a secreção do TSH são influenciadas pelos HT (feed back negativo) e pelo TRH (feed back positivo)(figura 1). Como resultado deste limitado controle na secreção de TSH, a secreção de HT é mantida dentro de limites muito estreitos. Uma exceção importante acontece quando a diminuição das concentrações séricas de T3, de ocorrência em pacientes com doença não-tireoideana, evidencia pouco efeito sobre a secreção do TSH, provavelmente porque o T4 sérico contribui mais para o conteúdo nuclear de T3 do hipotálamo e a hipófise do que em muitos outros tecidos.
Doenças da Tireoide
A tireoide é uma glândula localizada na parte anterior do pescoço responsável pela produção dos hormônios T3 (tiiodotironina) e T4 (tiroxina), os quais atuam em todo o nosso organismo, regulando o crescimento, digestão e o metabolismo.
Conforme Greenspan & Strewler (2000, p. 19):
Vários princípios gerais devem ser considerados na avaliação das doenças endócrinas. Os sinais e sintomas comumente são vagos e atribuíveis á ansiedade ou depressão, ou a causas não-endócrinas comuns. A apresentação inicial sutil destes distúrbios pode ser mascarada ainda mais por ações contra-reguladoras pelo organismo, para compensar a deficiência hormonal. A apresentação clínica de um determinado distúrbio pode diferir, dependendo de sua cronicidade, e um estado de deficiência pode apresentar-se como um problema agudo e grave em um paciente no qual as manifestações crônicas do distúrbio não tiveram tempo para se desenvolver.
Neste contexto, quando a tireoide não funciona adequadamente pode liberar hormônios em excesso (hipertireoidismo) ou em quantidade insuficiente (hipotireoidismo). De maneira geral, quando a glândula está hiperfuncionante ocorre uma aceleração do metabolismo em todo organismo, podendo ocorrer agitação, diarreia, taquicardia, perda de peso etc, ao contrário, quando a glândula está hipofuncionante pode ocorrer cansaço, fala arrastada, intestino preso, ganho de peso, etc.
Acredita-se que a relação inversa e dinâmica entre alterações nos níveis de TSH, T4 e T3 séricos, determina uma supressão ou elevação hormonal. Sendo assim, raramente os níveis de TSH normais excluem uma anormalidade primária na função da tireoide. O encontro de níveis de TSH alterados deverá seguir mensurações de HT circulantes para diagnóstico de hipertireoidismo com TSH suprimido, ou hipotireoidismo com TSH elevado. Usualmente, a mensuração de HT livres corresponde à sua viabilidade biológica. Em geral, avaliação de T4 livre é suficiente para confirmar tirotoxicose, ainda que de 2 a 5% dos pacientes apresentem variação apenas nos níveis de T3 (toxicose de T3) (KASPER et. al, 2004 apud OLIVEIRA, 2009).
Hipotireoidismo
No hipotireoidismo ocorre a deficiência dos hormônios da tireoide, que pode potencialmente afetar o funcionamento de todo o corpo. A taxa de funcionamento normal do corpo diminui causando lentidão mental e física. Os principais fatores de risco são idade superior a 50 anos, sexo feminino, obesidade, cirurgia de retirada da tireoide e exposição prolongada a radiação.
Vilar (2006, p. 534), explica que:
Hipotiroidismo é uma síndrome clínica resultante da deficiente produção ou ação dos hormônios tiroidianos, com consequente lentificação generalizada dos processos metabólicos. Pode ser primário (falência tiroidiana), secundário (causa hipofisária, por deficiência de tirotrofina ou TSH) ou terciário (deficiência hipotalâmica do hormônio liberador da tirotrofina ou TRH). A terminologia hipotiroidismo central é preferível, porque nem sempre é possível distinguirmos entre preferível, porque nem sempre é possível distinguirmos entre causas hipofisárias e hipotalâmicas. Hipotiroidismo pode, ainda, muito raramente, ser decorrente de uma resistência generalizada aos hormônios tiroidianos, causada por mutações nos seus receptores.
Nesse sentido, o hipotireoidismo é uma síndrome clínica resultante da produção ou ação biológica ineficiente dos HT promovendo um efeito generalizado de retardo nos processos metabólicos. As condições clínicas da síndrome dependem do grau e duração da deficiência de HT e, assim, afetará os tecidos em maior ou menor extensão. A manifestação durante a vida intrauterina determina os maiores danos sendo o HT fundamental no desenvolvimento cerebral do feto no primeiro trimestre de gestação (BURSELL, 2007 apud OLIVEIRA, 2009).
Weetman & McGregor (1994) apud Oliveira (2009. p. 43) afirma que:
Pode ser classificado como hipotireoidismo primário, quando há perda de função tireoideana; hipotireoidismo secundário, que tem como causa a origem hipofisária, pela deficiência de TSH; ou hipotireoidismo terciário, manifestado pela deficiência do TRH. Pode ainda, muito raramente, ser decorrente de uma resistência generalizada aos HT provocada por mutação nos receptores nucleares. Pode também ser dividido em congênito (deficiência no desenvolvimento da tireoide, dishormonogênese da tireoide, síndrome de Pendred, mutações no receptor de TSH, resistência ao HT), hipotireoidismo primário (tireoidite autoimune crônica (Hashimoto), pós-radioterapia de pescoço, pós-tireoidectomia e deficiência de iodo) e hipotireoidismo central (efeitos de drogas e doenças não tireoideanas).
Em pacientes com hipotireoidismo primário, a diminuição na secreção de T4 e T3 leva à sua redução no soro, apresentando como conseqüência um aumento compensatório na secreção de TSH. Assim, a combinação de baixo T4 e alto TSH confirma o diagnóstico de hipotiroidismo, indicando que pode ser devido à doença tireoideana primária (VILAR et al, 2001).
Ross (2008) apud Oliveira (2009, p. 46) expõe que:
A etiologia do hipotireoidismo primário pode manisfestar-se como conseqüência da diminuição na funcionalidade do tecido tireoideano (tireoidite de Hashimoto, sub-agudas, pós-parto, de Riedel, tratamento de hipertireoidismo, agenesia e ectópica tireoideana, radioterapia de cabeça e pescoço, defeitos funcionais na biossíntese e liberação dos HT) ou por disformogênese congênita (grave deficiência de iodo, drogas). No hipotireoidismo secundário pode haver perda de tecido funcional (tumores, traumas, deficiência vascular, infecções, doenças infiltrativas, hipofisite linfocítica crônica, lesões congênitas) ou por defeitos funcionais na biossíntese e liberação do TSH (mutações nos genes do receptor do TSH, drogas).
As causas mais comuns de hipotireoidismo, fora a deficiência de iodo, são as doenças autoimune (tireoidite de Hashimoto) e causas iatrogênicas (posterior a tratamento de hipertireoidismo). Processos autoimunes reduzem, gradualmente, a função tireoideana. Inicialmente há uma fase de compensação quando níveis normais de HT são mantidos pela elevação de TSH. Em alguns casos os pacientes podem ter menos sintomas, sendo chamados hipotireoidismo subclínico. Por fim, quando os níveis de T4 livre encontram-se suprimidos e TSH aumentados tornam os sintomas mais evidentes, usualmente com TSH > 10 um/L, e são identificados como hipotireoidismo clínico (KASPER et al, 2004 apud OLIVEIRA, 2009).
Observa-se que entre os fatores relacionados ao risco maior, estão a idade acima de 60 anos, sexo feminino, bócio, a doença nodular tireoidiana, histórico familiar da doença, histórico de radiografia de cabeça e pescoço, doença auto-imune tireoideana e extratireoidiama, drogas (lítio, amiodarona) e tabagismo. As manifestações clínicas presentes são a pele seca, diminuição da transpiração, epiderme fina e hiperqueratose do estrato córneo, mixedema, constipação, ganho de peso, libido diminuído, fertilidade reduzida, contratilidade do miocárdio e pulso reduzido, levando a forte redução do volume e bradicardia, problemas de memória e concentração.
As alterações clássicas do hipotiroidismo primário são níveis plasmáticos de TSH elevado e níveis plasmáticos baixos de T4 e T3 livres. Inicialmente observa-se apenas elevação do TSH (forma subclínica), em seguida, reduzem-se o T4 e em uma fase posterior o T3. Pode haver, também, uma secreção elevada de T3, de modo que em pelo menos 1/3 dos pacientes os níveis de T3 estão normais. Em hipotireoidismo secundário ou terciário (central) o TSH encontra-se baixo ou normal e T4 livre baixo (VILAR et al, 2006).
Hipertireoidismo
O Hipertireoidismo primário pode ser identificado como auto-imune (doença de graves, bócio multinodular e nódulo tóxico), tireoidite transitória (pós-parto, linfocítica e pós-viral), efeitos de drogas (ingestão de tiroxina, induzida por iodo, terapia de amiodarona), mutação em receptor TSH (por ganho de função), tireotoxicose gestacional e tumor de pituitária secretando TSH (WEETMAN, 1994 apud OLIVEIRA, 2009).
De acordo com Guyton (1989, p. 718):
Os anticorpos que causam hipertireoidismo desenvolve-se, quase certamente, em consequência da auto-imunidade que surge contra o tecido tireóideo. Presumivelmente, em alguma fase da vida do indivíduo, houve liberação de excesso de antígenos de célula tireóidea, que resultou na formação de anticorpos contra a própria glândula tireoide.
Portanto, observa-se que a causa mais comum do hipertireoidismo é uma doença auto-imune chamada Doença de Graves. Outras causas do hipertireoidismo incluem o bócio multinodular (aumento do volume da glândula que leva a produção excessiva dos hormônios), os tumores da glândula tireoide, da glândula pituitária, dos testículos ou dos ovários, a inflamação da tireoide resultante de uma infecção viral ou outra inflamação, a ingestão de quantidades excessivas de hormônio tireóideo e a ingestão excessiva de iodo.
A doença mais comum do hipertireoidismo, doença de graves, ocorre na presença de alguns graus de tireoidite crônica e pode ultimamente ser substituída, em longo tempo, por hipofunção tireoidiana. Doença da tireoide autoimune é caracterizada pela ocorrência no soro de anticorpos contra peroxidase tireoide (o antígeno microssomal), Tg e receptores de TSH. É caracterizada por infiltração não homogênea de linfócitos com uma ausência de destruição folicular. Os níveis de TSH no soro estão quase sempre totalmente suprimidos e os níveis de T4 e T3 estão mais aumentados que os níveis de T4 e T3. (WILSON, 1998 apud OLIVEIRA, 2009).
Wilson (1998) apud Oliveira (2009, p. 46) identifica como sinais e sintomas da doença de graves:
Perda de peso e fadiga, hiperatividade, irritabilidade, insônia, dificuldade de concentração, tremores, hiper-reflexiva, taquicardia, pele quente e úmida, intolerância ao calor, alopecia, tempo de trânsito gastrointestinal diminuído, oftalmopatia, bócio difuso e mixedema pretibial. Em pacientes idosos pode haver astenia intensa, fraqueza muscular e prostração ou depressão grave.
Por fim, vale ressaltar que a avaliação bioquímica da função tireoideana é refeita entre 3 a 4 semanas após iniciado o tratamento. É realizada titulação baseada nos níveis de T4 livre. Muitos pacientes não atingem estado eutireóideo dentro de 6 a 8 semanas após o tratamento ter sido iniciado. Os níveis de TSH permanecem muitas vezes suprimidos por vários meses e, portanto, não indicam um índice sensível da resposta ao tratamento.
Os sintomas iniciais do hipotireoidismo são inespecíficos, mas a fadiga intensa o desempenho das atividades diárias de um indivíduo.
De acordo com Brunner e Suddarth (2005):
Relatos de queda de cabelo, unhas quebradiças e pele seca são comuns, e podem ocorrer dormência e formigamento dos dedos. Ocasionalmente, a voz torna-se rouca, e o paciente pode queixar-se de rouquidão. Os distúrbios menstruais, como a menorragia ou amenorréia, acorrem além da perda da libido. O hipotireoidismo afeta as mulheres com frequência cinco vezes mais que os homens e ocorre mais amiúde entre 30 e 60 anos de idade.
Entre as manifestações clínicas do hipotireoidismo grave destaca-se alteração da temperatura e frequência de pulso. Geralmente o paciente começa a ganhar peso mesmo sem aumento da ingestão alimentar, embora os pacientes gravemente hipotireóideos possam ser caquéticos. A pele torna-se espessa por causa do acúmulo de mucopolissacarídeos nos tecidos subcutâneos (a origem do termo mixedema). O cabelo adelgaça-se e começam a cair; a face fica sem expressão e semelhante a uma máscara. O paciente queixa-se frequentemente de frio, mesmo em um ambiente quente.
Doença de Graves
Constata-se que entre as diversas causas de hipertireoidismo, a doença de Graves (DG) representa uma etiologia mais comum. Portanto, é considerada a causa mais comum do Hipertireoidismo, provocada por um defeito no sistema imunológico.
De acordo com Vilar et al. (2006, p. 547), a doença de Graves:
Tem origem auto-imune e sua prevalência é incerta, mas estima que afete 0,4% a 1% da população. Mostra-se 5 a 10 vezes mais comum em mulheres do que homens. Seu pico de incidência se dá entre a segunda e quarta década, mas a DG pode manifestar-se em qualquer faixa etária.
Dessa forma, a Doença de Graves pode vir acompanhada de outros distúrbios auto-imunes endócrinos e não-endócrinos.
A Doença de Graves foi descrita por Robert Graves como uma síndrome que consiste na presença de hipertireoidismo, bócio e orbitopatia e ocasionalmente como uma dermopatia referida como mixedema pré-tibial ou mixedema localizado. (CARVALHO, 1999).
Sabe-se que na fisiopatologia da doença, estão formados anticorpos contra auto-antígenos tireoides, com a tireoglobina (Tg), a tireoperoxidase (TPO) e o receptor de TSH (TSHR), este, auto-antígeno responsável pelo hipertireoidismo da doença. Conforme Roso e Ramão (2001, p. 227):
A tireoide na doença de Graves apresenta infiltração linfocitária não-homogênea e hiperplasia folicular. Essa população linfocitária é composta, sobretudo por células T e centros germinativos de células B2, e a glândula tireoide é o sítio primário da produção dos auto-anticorpos tireóideos na doença tireóidea auto-imune.
Vilar et al. (2006, p. 544) apresenta abaixo o processo da doença de Graves:
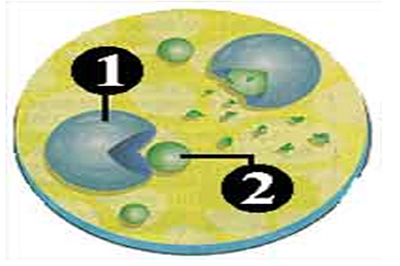
1 Linfócito – Os linfócitos são células que fazem parte do exército de defesa que identifica o que é do copo e o que é estranho a ele. Quando eles encontram um organismo desconhecido, atacam-no.
2 Organismo estranho – A doença de Graves se manifesta quando o sistema imunológico começa a estranhar as células da tireoide. Os hormônios são produzidos sem parar e o corpo aproveita toda a energia que recebe.
Por fim a bactéria Yersínia pode desencadear o defeito no sistema de defesa. Presente em muitos alimentos estragados, o microorganismo tem a mesma constituição genética da célula da tireoide. Os soldados de defesa se confundem e atacam tanto a bactéria quanto a glândula. (VILLAR, et al, 2006, p. 545)
Manifestações Clínicas
Os pacientes com hipertireoidismo bem desenvolvido exibem um característico grupo de sinais e sintomas (por vezes referidos como tireotoxicose). O sintoma apresentado é, com freqüência, o nervosismo. Em geral, esses pacientes são hiperexcitáveis, irritáveis e apreensivos; não podem ficar sentados tranquilamente; sofrem de palpitações; e seus pulsos são anormalmente rápidos em repouso, bem como sob esforço. Eles toleram menos calor e suam de forma incomum.
A pele fica continuamente ruborizada, com uma coloração salmão característica, sendo provável que fique quente, macia e úmida. No entanto, os pacientes idosos podem reportar a pele seca e o prurido difuso. Um tremor fino das mãos pode ser notado.
Os pacientes podem exibir exoftalmia (olhos abaulados), o que produz uma expressão facial assustada.
Brunner e Suddarth (2005, p. 1258) afirmam que entre as manifestações incluem:
Apetite e ingesta da dieta aumentados, perda de peso progressiva, fatigabilidade e fraquezas musculares anormais (dificuldade em subir escadas e para levantar-se de uma cadeira), amenorréia e alterações da função intestinal. A freqüência de pulso varia constantemente entre 90 e 160 batimentos/min; a pressão arterial sistólica, mas, de maneira característica, não a diastólica, mostra-se elevada; a fibrilação atrial pode acontecer; e a descompensação cardíaca na forma de insuficiência cardíaca é comum, sobretudo nos pacientes idosos. A osteoporose e a fratura também estão associadas ao hipertireoidismo. Os efeitos cardíacos podem incluir a taquicardia sinusal ou arritmias, pressão de pulso aumentada e palpitações; foi sugerido que essas alterações podem estar relacionadas com a sensibilidade aumentada às catecolaminas. A hipertrofia miocardica e a insuficiência cardíaca podem acontecer quando o hipertireoidismo é grave e não-tratado.
O curso da doença pode ser brando, caracterizado por remissões e exacerbações e terminando com a recuperação espontânea em alguns meses ou anos. De modo contrario, ela pode progredir de forma incessante, com a pessoa não-tratada tornando-se edemaciada, intensamente nervosa, delirante e, até mesmo, desorientada; mais adiante, a coração falha.
Os sintomas de hipertireoidismo podem acontecer com a liberação de quantidades excessivas de hormônio tireóideo em conseqüência da inflamação depois da irradiação ou destruição do tecido tireóideo por tumor. Certos sintomas também podem ocorrer com a administração excessiva de hormônio tireóideo para o tratamento do hipertireoidismo. O uso duradouro de hormônio tireóideo na ausência de monitoração rigorosa pode ser uma causa de sintomas de hipertireoidismo. Também é provável que resulte na osteoporose prematura, principalmente em mulheres.
Tratamento Médico
O tratamento do hipertireoidismo é dirigido no sentido de reduzir a hiperatividade tireóidea para aliviar os sintomas e remover a causa de complicações importantes. O tratamento depende da causa do hipertireoidismo e pode exigir uma combinação das abordagens terapêuticas.
Neste contexto, Brunner & Suddarth (2005, p. 1265) relata a combinação das seguintes terapias no tratamento do hipertireoidismo:
1. Terapia farmacológica: Duas formas de farmacoterapia estão disponíveis para tratar o hipertireoidismo e controlar a atividade tireóidea: (1) uso de irradiação por administração do radioisótopo I¹²³ ou I¹³¹ para os efeitos destrutivos sobre a tireoide e (2) medicamentos antitireóideos que interferem com a síntese de hormônios tireóideos e outros agentes que controlam as manifestações do hipertireoidismo. As duas drogas antitireoidianas disponíveis para uso no Brasil são o metimazol e o propiltiouracil. A remoção cirúrgica da maior parte glândula tireoide é uma alternativa não-farmacológica.
2. Terapia com lodo Radioativo: A meta da terapia com iodo radioativo (I¹²³ ou 1¹³¹) consiste em destruir as células tireóideas hiperativas uso do iodo radioativo é o tratamento mais comum nos pacientes idosos. Quase todo iodo que entra e é retido no corpo fica concentrado na glândula tireoide. Portanto, o isótopo radioativo do iodo concentra-se na glândula tireoide, onde ele destrói as células tireóideas sem colocar em risco os outros tecidos radiossensíveis. Durante um período de várias semanas, as células tireóideas expostas ao iodo radioativo são destruídas, resultando na redução do estado hipertireóideo e, inevitavelmente, em hipotireoidismo. O paciente é instruído sobre o que esperar com esse iodo radioativo incolor e sem sabor, que pode ser administrado pelo radiologista. Uma dose oral única do agente é administrada, com base estimada do peso tireóideo. Cerca de 70 a 85% dos pacientes são curados por uma dose de iodo radioativo. Um total de 10 a 20% adicionais requer duas doses; raramente há necessidade de uma terceira dose. O emprego de uma dose ablativa de iodo radioativo causa, inicialmente, uma liberação aguda de hormônio tireóideo a partir da tireoide e pode provocar um aumento dos sintomas. O paciente é observado para sinais da tempestade tireóidea; o propranolol é útil no controle desses sintomas.
Depois do tratamento com iodo radioativo, o paciente é acompanhado rigorosamente até que o estado eutireóideo seja alcançado. Em 3 a 4 semanas, diminuem os sintomas de hipertireoidismo. Com a incidência de hipotireoidismo depois dessa forma de tratamento é muito alta (i.e., mais de 90% em 10 anos), o acompanhamento rigoroso é necessário para avaliar a função tireóidea. É necessária a reposição do hormônio tireóideo; em geral, são prescritas pequenas doses, com a dose sendo gradualmente aumentada durante um período de meses (até aproximadamente 1 ano) até que os níveis de T4livre e TSH se estabilizem dentro elas faixas de normalidade.
O iodo radioativo tem sido utilizado para tratar os adenomas tóxicos e o bócio multinodular, bem como muitas variedades de tireotoxicose (raramente é bem-sucedido de maneira permanente); ele é preferido para tratar pacientes além dos anos reprodutivos com bócio tóxico difuso. Ele está contra-indicado na gravidez e em mães nutrizes, porque o iodo radioativo atravessa a placenta e é secretado no leite materno. Uma vantagem importante do tratamento com iodo radioativo é que ele evita muitos dos efeitos colaterais associados aos medicamentos antitireóideos.
No entanto, muitos pacientes e suas famílias temem os medicamentos que são radioativos. Por causa desse medo, muitos pacientes optam por tomar os medicamentos antitireóideos em lugar do iodo radioativo.